
La ciencia que hace morir al cáncer: Estrategias desde el laboratorio
Carlos Alberto García Torres1, Brenda Lizbeth Arroyo Reyes2*, Plácido Zaca Morán3
1Facultad de Ciencias Biológicas, Benemérita Universidad Autónoma de Puebla, Avenida San Claudio y 18 Sur, C.P. 72570 Puebla, Puebla, México. carlos.garciato@alumno.buap.mx
2Instituto de Fisiología, Benemérita Universidad Autónoma de Puebla, Prol. de la 14 Sur, C.P. 72592, Puebla, Puebla, México. brenda.arroyore@alumno.buap.mx
3Instituto de Ciencias, Benemérita Universidad Autónoma de Puebla, Ecocampus Valsequillo, Independencia O 2 Sur 50, C.P. 72960, Puebla, Puebla, México. placido.zaca@correo.buap.mx
*Autor para correspondencia
¿Qué pasa cuando una célula cancerosa deja de obedecer las reglas y se vuelve inmortal? En este trabajo explicamos cómo, desde el laboratorio, los científicos activan mecanismos naturales de muerte celular —como la apoptosis, necroptosis y autosis— para detener el crecimiento del cáncer. Estos estudios, realizados en modelos in vitro (los experimentos en laboratorio), abren nuevas posibilidades para terapias más precisas y seguras.
¿Cómo mueren las células cancerosas? La ciencia detrás de una batalla silenciosa
El cáncer es una de las enfermedades más letales en el mundo. Pero ¿Por qué es tan difícil de detener? La razón está en cómo se comportan las células cancerosas: se multiplican rápidamente, de forma desordenada y sin respetar las reglas que mantienen el equilibrio en nuestro cuerpo. Es como si olvidaran su función en el cuerpo y se transformaran en células malignas que invaden tejidos cercanos y dañan órganos. Esta transformación puede deberse a factores genéticos o ambientales que alteran los mecanismos que normalmente regulan el crecimiento y muerte de las células.
Las células, como los organismos vivos, nacen, crecen, se reproducen y mueren. Pero cuando este ciclo natural se altera, las células pueden comenzar a dividirse sin control o evitar su propia muerte, lo que puede dar origen al cáncer. Cuando una célula deja de funcionar correctamente, lo ideal es que muera de manera ordenada, sin causar daño a las células vecinas ni generar inflamación. Este proceso de muerte controlada es esencial para mantener el equilibro de los tejidos en el cuerpo. Sin embargo, en las células cancerosas, este sistema de control está dañado. Es decir, las células cancerosas ya no responden a las señales que les indican cuando deben morir. Por eso, una de las estrategias más prometedoras de la ciencia ha sido buscar formas de reprogramar estas células para que se destruyan a sí mismas, reactivando los mecanismos naturales de muerte. Entre estos mecanismos destacan tres tipos de muerte celular controlada: la apoptosis, la autosis y la necroptosis.
Ahora bien, ¿Cómo estudiamos esta enfermedad en el laboratorio sin poner en riesgo a nadie? Para entender cómo se comportan las células cancerosas, los científicos recurren a modelos in vitro, es decir, experimentos realizados fuera del cuerpo humano, en un laboratorio con condiciones controladas. Estos modelos permiten simular el entorno celular, observar cómo se comportan las líneas celulares cancerosas y estudiar la forma de hacer que mueran sin dañar a las células sanas. Gracias a esta herramienta, se pueden obtener resultados rápidos, reproducibles y seguros, antes de pasar a estudios clínicos en pacientes.
Entonces, ¿Cómo se destruyen a las células cancerosas sin afectar a las sanas? Los estudios in vitro permiten a los investigadores observar, paso a paso, lo que ocurre dentro de una célula cancerosa y buscar nuevas formas de atacarla con precisión. Esta investigación es clave para entender el cáncer y diseñar terapias más efectivas.
¿Cuál es la mejor forma de morir?
Uno de los principales temas que se estudia en modelos in vitro es cómo las células mueren de manera natural cuando están dañadas, debido a que las células cuentan con varios mecanismos naturales para eliminar células dañinas sin afectar a las sanas. Uno de ellos es la apoptosis, una especie de “suicidio celular” que ocurre de forma ordenada y sin causar daños a su entorno. Este proceso ocurre de manera ordenada y evita que las células dañadas, envejecidas o defectuosas se acumulen en el cuerpo. Gracias a la apoptosis, los tejidos se mantienen saludables y en equilibrio (Figura 1). Sin embargo, en las células cancerosas, este mecanismo suele estar bloqueado. Algunas células activan proteínas que impiden su autodestrucción, mientras que otras desactivan las enzimas necesarias para iniciar el proceso. Estas enzimas, llamadas caspasas, actúan como tijeras moleculares que cortan proteínas dentro de la célula para iniciar su degradación. Entonces, cuando la apoptosis no funciona bien, las células dañadas pueden seguir multiplicándose. Por este motivo, los tratamientos contra el cáncer buscan precisamente volver a activar este proceso natural de muerte celular. Pero cuando la apoptosis falla hay otros menos ordenados, pero igual de útiles.
Otro es la necroptosis, en la que la célula muere rompiendo su membrana de forma controlada, liberando su contenido sin generar una inflamación grave. Gracias a este control, es posible reducir los daños colaterales que normalmente acompañan a una inflamación intensa. Por esta razón, los científicos están explorando cómo activar la necroptosis de forma dirigida para eliminar células cancerosas sin afectar a las células vecinas sanas.
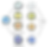
Figura 1. Comparación entre apoptosis, autosis, necroptosis y necrosis
Finalmente, existe la autosis, que sucede cuando un proceso llamado autofagia — el sistema de reciclaje celular — se activa por tiempo prolongado y no se autorregula adecuadamente y termina provocando la muerte de la célula. En condiciones normales, la autofagia ayuda a las células sanas a sobrevivir, especialmente en entornos adversos como privación de oxígeno o nutrientes (Figura 1). La autofagia comienza con la formación de una “burbuja” que envuelve lo que se necesita reciclar. Posteriormente, un organelo que contiene proteínas de degradación, llamado lisosoma, se une a esta burbuja para iniciar el proceso de degradación y reciclaje (Figura 2).
Estudiar estos mecanismos ayuda a los científicos a diseñar tratamientos que activen estas vías de muerte en las líneas celulares cancerosas.
Pero existe un tipo de muerte celular que a los científicos no les gusta nada: la necrosis. Es como una explosión dentro de la célula, que rompe su membrana de forma violenta, derrama todo su contenido y causa una inflamación descontrolada que puede dañar a las células sanas de alrededor. Por sus efectos caóticos, es un proceso que se busca evitar en los tratamientos contra el cáncer (Figura 1).
Los procesos controlados de muerte celular se han utilizado como enfoque en las terapias contra el cáncer y han permitido tener una mejor comprensión de cómo inhibir el crecimiento de las líneas celulares cancerosas disminuyendo efectos indeseables.

Figura 2. Etapas que conforman el proceso de la autofagia.
Para poder estudiar estos mecanismos de muerte celular con detalle y encontrar formas de reactivarlos en células cancerosas, los científicos necesitan modelos confiables que puedan manipular en el laboratorio. Para lograrlo las líneas celulares han sido una herramienta clave para avanzar en el conocimiento del cáncer.
Líneas celulares: los modelos invisibles que nos ayudan a entender el cáncer
A principios del siglo XX, el científico Ross Harrison dio un paso histórico. Logró mantener células vivas fuera de un organismo. En 1907, extrajo una pequeña parte del sistema nervioso de un embrión de rana y la colocó en una gota de linfa (líquido transparente que circula en nuestro cuerpo) sobre un portaobjetos. Al solidificarse, creó así el primer cultivo celular en suspensión. Gracias a este ingenioso montaje, pudo observar al microscopio cómo crecían las fibras nerviosas in vitro, es decir, fuera del cuerpo del animal (Figura 3). Desde ese experimento pionero, el cultivo celular se ha convertido en una herramienta importante en la biología moderna: permite estudiar enfermedades, probar medicamentos y, como en este caso, entender cómo mueren las líneas celulares cancerosas.
Figura 3. Diagrama del tubo neural de un embrión de rana en contacto con una gota de linfa.
Con el paso del tiempo, el cultivo celular fue perfeccionándose. Al principio, uno de los mayores desafíos era mantener vivas a las células fuera del cuerpo durante pocas horas. Los primeros intentos usaban ingredientes naturales como plasma de pollo o extractos de embriones, pero estos eran difíciles de estandarizar y variaban mucho de un experimento a otro. Fue hasta la década de 1950 que los científicos descubrieron qué nutrientes necesitaban realmente las células para sobrevivir y multiplicarse. Ese avance permitió crear medios de cultivo más precisos, adaptados a cada tipo celular, lo que abrió la puerta a investigaciones más confiables y repetibles.
La mayoría de las células humanas obtenidas directamente de los tejidos tienen una vida limitada. Con el tiempo, tras acumular daños en su material genético, las células envejecen y dejan de dividirse. A esto se le llama senescencia celular. Y aunque las células siguen activas, ya no se dividen y cambian tanto en su forma como en su comportamiento, volviéndolas inviables para su estudio en el laboratorio. Para resolver esta limitación, los científicos han desarrollado técnicas que permiten “inmortalizar” las células. Esto no significa que vivan para siempre, pero sí que pueden dividirse una y otra vez sin morir como lo harían normalmente. Es como si les dieran una especie de “pase libre” para seguir funcionando sin envejecer rápido. Para lograrlo, los científicos usan ciertos cambios genéticos o toman células que ya tienen esa capacidad, como algunas células cancerosas. Esas células siguen vivas en laboratorios de todo el mundo y han ayudado a descubrir muchas cosas sobre enfermedades, vacunas y tratamientos.
El estudio del cáncer es actualmente uno de los campos donde los cultivos celulares han demostrado mayor utilidad, ya que las líneas celulares cancerosas permiten investigar in vitro los mecanismos moleculares implicados en esta enfermedad y, en consecuencia, desarrollar tratamientos más efectivos.
Matar al cáncer sin dañar lo sano: cómo la ciencia programa la muerte celular
En el laboratorio, los científicos han buscado formas de eliminar las líneas celulares cancerosas sin dañar a las células sanas. Para lograrlo, estudian los distintos tipos de muerte celular y sus efectos. Estas investigaciones han permitido clasificar las estrategias en dos grandes grupos: las que usan compuestos químicos y las que emplean métodos físicos.
Por un lado, las terapias químicas incluyen sustancias naturales y compuestos sintéticos. Algunos extractos naturales, obtenidos de plantas, hongos o incluso de organismos marinos, han demostrado tener compuestos capaces de inducir apoptosis. Por ejemplo, extractos de Hamelia patens, Dioon spinulosum y Gossypium schottii han provocado apoptosis en líneas celulares de cáncer de nasofaringe, cuello uterino y células escamosas de tejidos (como piel, esófago y pulmones). Además, la shikonina, un compuesto extraído de raíces secas de Lithospermum erythrorhizon, ha demostrado activar necroptosis en células de cáncer de pulmón. Por su parte, extractos de esponjas y algas marinas, ricos en alcaloides y polisacáridos, han mostrado inducir apoptosis en células de cáncer colorrectal. Incluso, algunos compuestos naturales pueden activar autosis (Figura 4a). En paralelo, los fármacos diseñados en el laboratorio también han mostrado eficacia. Medicamentos como trametinib y palbociclib han demostrado inducir apoptosis en líneas celulares de cáncer de pulmón. Otro ejemplo interesante es el compuesto ABT-737, que bloquea proteínas que normalmente impiden la muerte celular, haciendo que las células de cáncer de ovario sean más sensibles al fármaco cisplatino, con lo cual se refuerza la apoptosis.
Por otro lado, las terapias físicas utilizan herramientas como la luz o el calor para atacar directamente a las líneas celulares cancerosas. Por ejemplo, ciertas nanopartículas —como las de oro, plata, zinc o diamantes— pueden acumularse dentro de las células tumorales. Al ser activadas con luz láser, generan calor desde el interior y provocan su autodestrucción (Figura 4b). Este enfoque, conocido como hipertermia localizada, busca eliminar solo las células dañinas induciendo apoptosis o autosis.
En particular, los nanodiamantes han demostrado ser eficaces para activar apoptosis en células de cáncer óseo, gracias a su capacidad de alterar componentes vitales como los lípidos y proteínas causando autosis al generar estrés interno, incluso sin necesidad de luz.
Aunque estas terapias son prometedoras, deben ser cuidadosamente ajustadas. Uno de los principales retos para los investigadores es lograr una dosis precisa de calor que destruya las líneas celulares cancerosas sin provocar necrosis, evitando buscar este tipo de muerte en un tratamiento oncológico.
A)
B)
Figura 4. Célula cancerosa con múltiples núcleos a) en proceso de autosis inducida por tratamientos químicos. b) en proceso de apoptosis inducida por tratamientos físicos.
Conclusiones
Estudiar células cancerosas fuera del cuerpo —en modelos in vitro— ha sido de gran importancia para la humanidad al ayudar a entender cómo se regulan sus mecanismos de muerte celular. Gracias a estas investigaciones, se han identificado procesos como la apoptosis, necroptosis y autosis, que permiten eliminar células dañinas sin afectar a las sanas. Hoy sabemos que es posible inducir estos procesos con extractos naturales, fármacos o incluso usando luz láser y nanomateriales. Aunque los modelos in vitro tienen limitaciones, el trabajo conjunto entre distintas disciplinas está impulsando terapias más precisas y seguras, cada vez más cerca de ser aplicadas en pacientes.
Ficha biográfica de los autores
Carlos Alberto García Torres es estudiante de la licenciatura en Biología de la Benemérita Universidad Autónoma de Puebla
Brenda Lizbeth Arroyo Reyes es maestra en Tecnologías en Materiales Avanzados por el Instituto de Ciencias de la Benemérita Universidad Autónoma de Puebla
Plácido Zaca Morán es doctor en ciencias en Óptica por el Instituto Nacional de Astrofísica Óptica y Electrónica
Referencias
Aljabali, A. A. A., Obeid, M. A., Bakshi, H. A., Alshaer, W., Ennab, R. M., Al-Trad, B., Khateeb, W. Al, Al-Batayneh, K. M., Al-Kadash, A., Alsotari, S., Nsairat, H., & Tambuwala, M. M. (2022). Synthesis, Characterization, and Assessment of Anti-Cancer Potential of ZnO Nanoparticles in an In Vitro Model of Breast Cancer. Molecules, 27(6). https://doi.org/10.3390/molecules27061827
Bai, L., Wu, Q., Zhang, X., & Zhao, Y. (2023). Autosis as a selective type of cell death. In Frontiers in Cell and Developmental Biology (Vol. 11). Frontiers Media S.A. https://doi.org/10.3389/fcell.2023.1164681
Castillo, J. (2013). Nanotubos de carbono en la terapia fototérmica contra el cáncer. Innovaciencia, 1(1), 5–10. https://doi.org/10.15649/2346075X.209
Gong, Y., Fan, Z., Luo, G., Yang, C., Huang, Q., Fan, K., Cheng, H., Jin, K., Ni, Q., Yu, X., & Liu, C. (2019). The role of necroptosis in cancer biology and therapy. In Molecular Cancer (Vol. 18, Issue 1). BioMed Central Ltd. https://doi.org/10.1186/s12943-019-1029-8
Han, N., Li, J., & Li, X. (2022). Natural Marine Products: Anti‐Colorectal Cancer In Vitro and In Vivo. In Marine Drugs (Vol. 20, Issue 6). MDPI. https://doi.org/10.3390/md20060349
Hanahan, D., & Weinberg, R. A. (2011). Hallmarks of cancer: The next generation. In Cell (Vol. 144, Issue 5, pp. 646–674). https://doi.org/10.1016/j.cell.2011.02.013
Ibrahim, M., Xue, Y., Ostermann, M., Sauter, A., Steinmueller-Nethl, D., Schweeberg, S., Krueger, A., Cimpan, M. R., & Mustafa, K. (2018). In vitro cytotoxicity assessment of nanodiamond particles and their osteogenic potential. Journal of Biomedical Materials Research - Part A, 106(6), 1697–1707. https://doi.org/10.1002/jbm.a.36369
Keremidarska, M., Ganeva, A., Mitev, D., Hikov, T., Presker, R., Pramatarova, L., & Krasteva, N. (2014). Comparative study of cytotoxicity of detonation nanodiamond particles with an osteosarcoma cell line and primary mesenchymal stem cells. Biotechnology and Biotechnological Equipment, 28(4), 733–739. https://doi.org/10.1080/13102818.2014.947704
Kim, H. J., Hwang, K. E., Park, D. S., Oh, S. H., Jun, H. Y., Yoon, K. H., Jeong, E. T., Kim, H. R., & Kim, Y. S. (2017). Shikonin-induced necroptosis is enhanced by the inhibition of autophagy in non-small cell lung cancer cells. Journal of Translational Medicine, 15(1). https://doi.org/10.1186/s12967-017-1223-7
Kiraz, Y., Adan, A., Kartal Yandim, M., & Baran, Y. (2016). Major apoptotic mechanisms and genes involved in apoptosis. In Tumor Biology (Vol. 37, Issue 7, pp. 8471–8486). Springer Science and Business Media B.V. https://doi.org/10.1007/s13277-016-5035-9
Li, X., Guo, Y., Xing, Z., Gong, T., Yang, L., Yang, T., Chang, B., Wang, X., Yu, B., & Guo, R. (2024). ABT-737 increases cisplatin sensitivity through the ROS-ASK1-JNK MAPK signaling axis in human ovarian cancer cisplatin-resistant A2780/DDP cells. Oncology Reports, 52(3). https://doi.org/10.3892/or.2024.8781
Li, Z., Guo, D., Yin, X., Ding, S., Shen, M., Zhang, R., Wang, Y., & Xu, R. (2020). Zinc oxide nanoparticles induce human multiple myeloma cell death via reactive oxygen species and Cyt-C/Apaf-1/Caspase-9/Caspase-3 signaling pathway in vitro. Biomedicine and Pharmacotherapy, 122. https://doi.org/10.1016/j.biopha.2019.109712
Martínez-Torres, A. C., Uscanga-Palomeque, A. C., & Rodríguez-Padilla, C. (2016). Actividad citotóxica in vitro frente a células tumorales. In Investigación en plantas de importancia médica (pp. 269–312). OmniaScience. https://doi.org/10.3926/oms.318
Paskeh, M. D. A., Entezari, M., Clark, C., Zabolian, A., Ranjbar, E., Farahani, M. V., Saleki, H., Sharifzadeh, S. O., Far, F. B., Ashrafizadeh, M., Samarghandian, S., Khan, H., Ghavami, S., Zarrabi, A., & Łos, M. J. (2022). Targeted regulation of autophagy using nanoparticles: New insight into cancer therapy. Biochimica et Biophysica Acta - Molecular Basis of Disease, 1868(3). https://doi.org/10.1016/j.bbadis.2021.166326
Salazar, M. M. (2009). Técnicas para la detección de apoptosis y senescencia celular in vitro y su importancia en biotecnología de la salud. In Rev. Colomb. Biotecnol: Vol. XI (Issue Diciembre).
Tao, Z., Le Blanc, J. M., Wang, C., Zhan, T., Zhuang, H., Wang, P., Yuan, Z., & Lu, B. (2016). Coadministration of trametinib and palbociclib radiosensitizes KRAS-mutant non-small cell lung cancers in vitro and in vivo. Clinical Cancer Research, 22(1), 122–133. https://doi.org/10.1158/1078-0432.CCR-15-0589
Yun, C. W., & Lee, S. H. (2018). The roles of autophagy in cancer. In International Journal of Molecular Sciences (Vol. 19, Issue 11). MDPI AG. https://doi.org/10.3390/ijms19113466
Zhang, X., Chen, L. X., Ouyang, L., Cheng, Y., & Liu, B. (2012). Plant natural compounds: Targeting pathways of autophagy as anti-cancer therapeutic agents. Cell Proliferation, 45(5), 466–476. https://doi.org/10.1111/j.1365-2184.2012.00833.x
.png)





