Biotecnología Azul: El poder oculto de la mucosidad de los pulpos
Macario Savin Amador 1,2*, Liliana Hernández Olalde 2, Oscar Trujillo-Millán 2
1.Universidad Tecnológica de La Paz, SN, La Paz, Baja California Sur.
2. Universidad Autónoma de Baja California Sur, La Paz B.C.S.
*Correspondencia: msavin@utlp.edu.mx
¿Quiénes son los pulpos?
Si conoces a los pulpos, ya sea por verlos en algún documental, película o en un acuario, tal vez piensas en cómo cambian de color, cómo se escabullen por grietas estrechas o de dónde proviene la tinta que liberan para escapar de sus depredadores. Los pulpos pertenecen al grupo de los cefalópodos, moluscos marinos de cuerpo blando que se caracterizan por su cabeza grande, así como por poseer ocho brazos, capacidad de camuflaje, ojos similares a los de los vertebrados, tres corazones y un sistema nervioso altamente desarrollado (Jereb y Roper, 2005). Los pulpos han asombrado a los científicos por su notable inteligencia, pero estos increíbles animales esconden otro secreto aún más asombroso: la mucosidad de su piel. La mucosidad, es una sustancia viscosa producida naturalmente por la piel de los pulpos, que no solo los protege de su entorno, sino que contiene moléculas bioactivas (sustancias con actividad biológica que afectan directamente a un organismo vivo de manera positiva o negativa según la sustancia, la dosis y su biodisponibilidad (Schachter y Williams, 1982; Allam y Espinosa, 2015)) con un enorme potencial para su uso en la biotecnología, la medicina y la sostenibilidad de su cultivo (Pérez-Polo et al., 2023).
¿Por qué son resbaladizos los pulpos?
La característica resbaladiza de los pulpos se debe a una capa de mucosidad que recubre su piel, la cual es producida por dos tipos de células especializadas llamadas “células caliciformes” y mucocitos (Schmidtberg., 1999; Allam y Espinosa, 2015; Parra et al., 2015; Anadón, 2019). Cabe destacar que la mucosa es el tejido epitelial que recubre la superficie interna de órganos o estructuras, incluyendo la piel de algunos animales marinos como los pulpos. Esta mucosa contiene células especializadas encargadas de secretar la mucosidad, una sustancia viscosa que cumple funciones protectoras, fisiológicas e inmunológicas. Este moco está formado por agua, electrolitos, células epiteliales y sanguíneas, así como por proteínas (mucinas) y otras moléculas bioactivas; facilita el locomoción o movimiento y el deslizamiento, permitiéndoles moverse con agilidad sobre superficies rugosas o atravesar grietas estrechas sin lastimarse. Al reducir la fricción, el moco actúa como una especie de lubricante natural que protege su piel y mejora su desplazamiento por el fondo marino (Guardiola et al., 2015). Así mismo, el moco es una de las primeras líneas de interacción de los pulpos con el entorno, y cumple con otras funciones esenciales para su supervivencia.
¿Qué otras funciones tiene la mucosidad?
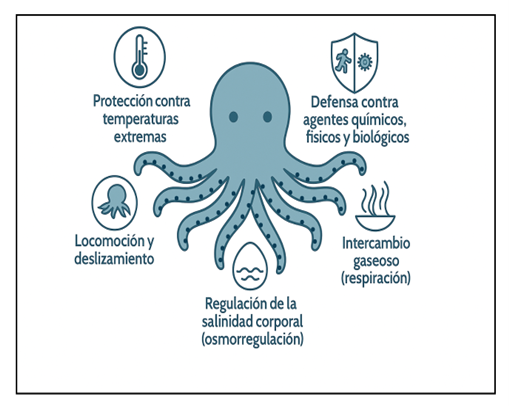
De acuerdo con Allam y Espinosa, (2015); Guardiola et al., (2015) y Fernández-Alacid et al., (2018) la mucosidad de la piel de los pulpos cumple con múltiples funciones fundamentales como (Fig.1):
Protección contra temperaturas extremas.
Locomoción y deslizamiento.
Regulación de la salinidad corporal (osmorregulación).
Intercambio gaseoso (respiración).
Defensa contra agentes químicos, físicos y biológicos.
Las cuales se detallan a continuación:
La mucosidad funciona como protección frente a temperaturas extremas, al actuar como un aislante natural que ayuda a estabilizar la temperatura corporal de los pulpos cuando hay cambios bruscos en el ambiente. Esta capa de moco evita que el frío o el calor afecten directamente a los tejidos, algo especialmente importante para especies como el pulpo Octopus vulgaris, que habita zonas costeras con variaciones térmicas significativas (Allam y Espinosa, 2015).
Figura 1. Funciones principales de la mucosidad de la piel en los pulpos. Elaboración propia con Open IA.
Otra función esencial es la osmorregulación, es decir, el control del equilibrio de agua y sales dentro del cuerpo. La mucosidad de la piel contribuye a que los pulpos mantengan su estabilidad hídrica e iónica interna incluso cuando cambian las condiciones de salinidad en el entorno. Esta regulación es vital para que sus células no se dañen por exceso o falta de agua (Allam y Espinosa, 2015). Asimismo, la mucosidad participa en el intercambio gaseoso, especialmente en regiones de la piel del pulpo que están muy vascularizadas (ricas en vasos sanguíneos que transportan oxígeno y nutrientes). Aunque la respiración se realiza principalmente en las branquias, el moco puede facilitar el paso de oxígeno y dióxido de carbono a través de la superficie de la piel, complementando así la función respiratoria (Fernández-Alacid et al., 2018).
La mucosidad: una barrera activa de protección
Una de sus funciones más importantes de la mucosidad es la defensa contra agentes químicos, físicos y biológicos (Savin-Amador et al., 2024). La mucosidad de la piel de los pulpos contiene una mezcla compleja de sustancias proteicas que el cuerpo usa para crecer, moverse, defenderse y mantenerse sano como: las mucinas (proteínas especiales que le dan al moco su textura pegajosa y resbaladiza), péptidos antimicrobianos (pequeñas proteínas que atacan y eliminan microbios dañinos) y enzimas (proteínas especiales que aceleran las reacciones químicas dentro de las células). Estos compuestos bioactivos protegen a los pulpos de bacterias, virus, hongos y toxinas del medio ambiente. El moco actúa como una primera línea inmunológica (sistema de defensa del cuerpo) que no solo bloquea el ingreso de patógenos (microorganismos que pueden causar enfermedades), sino que también neutraliza estas amenazas. Esta función ha sido respaldada por estudios recientes en moluscos cefalópodos, que han identificado componentes del sistema inmune innato (la primera línea de defensa que tienen todos los seres vivos contra las infecciones) en la mucosidad. Estos componentes incluyen histonas (proteínas que ayudan a empaquetar y organizar el ácido desoxirribonucleico o ADN dentro de las células), lectinas (proteínas que ayudan al cuerpo a reconocer lo que es propio y lo que es extraño, especialmente microbios), defensinas (pequeños fragmentos de proteínas que actúan como armas naturales del cuerpo para destruir microbios) y proteínas del complemento (un conjunto de proteínas que forman parte del sistema inmune y que ayudan a eliminar microbios al marcar a los patógenos para su destrucción o al perforar sus membranas celulares) (Pérez-Polo et al., 2023; Roura et al., 2024).
Además de sus funciones físicas, la mucosidad actúa como un reservorio de moléculas del sistema inmunitario innato (Allam y Espinosa, 2015; Guardiola et al., 2015; Fernández-Alacid et al., 2018; Parra et al., 2025). Diversos estudios han demostrado que contiene compuestos con propiedades antimicrobianas, capaces de atacar o inhibir microorganismos, y antioxidantes, que protegen las células del daño causado por radicales libres generados tanto por procesos naturales como por factores ambientales (Benoist et al., 2020; Suárez et al., 2021; Savin-Amador et al., 2024). Aunque el sistema inmunológico asociado a la mucosidad en cefalópodos aún está en fase de exploración, en Octopus vulgaris se han identificado proteínas clave como histonas con actividad antimicrobiana, proteínas tipo lectina implicadas en el reconocimiento de patógenos, y proteínas similares al factor H, que participan en la regulación del sistema del complemento, evitando que el sistema inmunológico ataque por error las propias células del organismo (Pérez-Polo et al., 2023; Roura et al., 2024).
¿Qué puede revelar la mucosidad?
El análisis de la mucosidad permite conocer cómo factores como la estacionalidad, la ubicación geográfica, el estado de madurez o el estrés influyen en la cantidad y calidad de las proteínas y compuestos bioactivos presentes (Allam y Espinosa, 2015).
Para entender mejor cómo varía la mucosidad del pulpo según distintos factores, los científicos utilizan el análisis del proteoma, es decir, el estudio del conjunto completo de proteínas que produce un organismo, tejido o célula en un momento determinado. Para ello, se extrae la mucosidad del pulpo y se someten a técnicas como la electroforesis en gel, que permite separar las proteínas según su tamaño, y la espectrometría de masas, una herramienta que identifica y mide con gran precisión las proteínas presentes. Estas tecnologías ayudan a detectar qué proteínas están activas, en qué cantidad, y si han cambiado por efecto del ambiente, el estrés o una enfermedad (Addis et al., 2013) (Fig. 2). El análisis proteómico de la mucosidad de la piel de los pulpos permite:
● Evaluar la respuesta inmunitaria.
● Identificar biomarcadores, es decir, señales que indican si el animal está sano, estresado o enfermo.
● Monitorear el impacto de las condiciones de cultivo.
● Detectar cambios tempranos asociados al estrés o a enfermedades.
● Descubrir péptidos y proteínas con propiedades bioactivas que podrían tener aplicaciones en medicina, farmacología o nutrición.
Además, identificar proteínas específicas podría ayudar a distinguir etapas de senescencia (envejecimiento), un momento crítico en la vida de los pulpos (Holst et al., 2022; Roura et al., 2024).
En la Figura 2A se muestra cómo uno de los usos biotecnológicos más importantes del análisis del proteoma es evaluar la respuesta inmunitaria del pulpo. A través de esta técnica, es posible identificar proteínas clave del sistema inmune innato presentes en la mucosidad, como histonas, lectinas, defensinas y proteínas del complemento, que actúan frente a bacterias, virus u hongos. Su detección permite conocer el estado inmunológico del animal de forma no invasiva. Además, el estudio del proteoma permite identificar biomarcadores (Fig. 2B), es decir, señales naturales que revelan si el pulpo está sano, estresado o enfermo. Estas pistas moleculares pueden ayudar a tomar decisiones rápidas en el manejo de los animales en cautiverio, mejorando su cuidado y prevención de enfermedades.
Otro aspecto clave es que este tipo de análisis permite monitorear el impacto de las condiciones de cultivo (Fig. 2C). Los pulpos que viven en ambientes naturales, en acuarios o en sistemas de cultivo muestran diferencias en la composición de su mucosidad (Pérez-Polo et al., 2023). Al comparar estas diferencias, se puede saber cómo afectan factores como el encierro, la alimentación, la calidad del agua o el manejo general. También se ha visto que la mucosidad puede ayudar a detectar cambios tempranos relacionados con el estrés o las enfermedades (Fig. 2D). Algunos compuestos proteicos se modifican desde las primeras etapas de deterioro, incluso antes de que el animal muestre síntomas visibles (Pérez-Polo et al., 2023). Esta capacidad de alerta temprana es muy valiosa tanto para la investigación como para la conservación y producción sostenible. Además, el análisis del proteoma permite identificar péptidos y proteínas bioactivas (Fig. 2E), muchas de ellas con funciones antimicrobianas, antiinflamatorias o regenerativas. Estos compuestos naturales son de gran interés para el desarrollo de aplicaciones biotecnológicas, como nuevos tratamientos contra enfermedades autoinmunes, infecciones resistentes a antibióticos, o terapias regenerativas para la piel y tejidos dañados. También pueden emplearse como ingredientes funcionales en suplementos nutricionales con propiedades inmunoestimulantes o antioxidantes.

Figura 2. Aplicaciones principales del estudio de la composición de proteínas (proteoma) de la mucosidad de los pulpos. Elaboración propia con Open IA..
Dado que el sistema inmunológico mucosal de los cefalópodos aún es poco conocido, este tipo de hallazgos representan un avance significativo. De hecho, recientemente se ha logrado la primera caracterización global del proteoma de la mucosidad de O. vulgaris mediante técnicas de proteómica, lo cual abre nuevas oportunidades para la investigación biomédica y acuícola (Suárez et al., 2021).
Conclusiones
La mucosidad de los pulpos, viscosa pero vital, no solo los protege de su entorno, sino que además representa una fuente valiosa para la innovación científica. Diversos estudios han identificado en su composición péptidos y proteínas con propiedades antimicrobianas, capaces de inhibir el crecimiento de bacterias patógenas incluso resistentes a antibióticos convencionales (Pérez-Polo et al., 2023; Savin-Amador et al., 2024). Esta capacidad la convierte en una candidata prometedora para el desarrollo de nuevos antibióticos de origen marino. Asimismo, las propiedades regenerativas y estructurales de ciertas proteínas presentes en la mucosidad podrían aprovecharse en el diseño de biomateriales con aplicaciones en medicina, como recubrimientos para heridas o matrices para ingeniería de tejidos. Por lo tanto, el estudio de la mucosidad de O. vulgaris y Octopus bimaculatus no solo amplía nuestro conocimiento sobre la inmunidad en cefalópodos, sino que también podría ser clave para enfrentar desafíos globales en salud, biotecnología y sostenibilidad.
Referencias
Addis, M.F. (2013). Farmed and wild fish. In Proteomics in Foods (pp. 181–203). Springer Science+Business Media: New York, NY, USA.
Allam, B., Espinosa, E.P. (2015). Mucosal immunity in mollusks. In Mucosal Health in Aquaculture (pp. 325–370). Academic Press: Cambridge, MA, USA.
Anadón, R. (2019). Functional histology: The tissues of common coleoid cephalopods. In Handbook of Pathogens and Diseases in Cephalopods (pp. 39–85). Springer Nature: Cham, Switzerland. https://doi.org/10.1007/978-3-030-11330-8_4
Benoist, L., Houyvet, B., Henry, J., Corre, E., Zanuttini, B., Zatylny-Gaudin, C. (2020). In-depth in silico search for cuttlefish (Sepia officinalis) antimicrobial peptides following bacterial challenge of haemocytes. Marine Drugs, 18, 439. https://doi.org/10.3390/md18090439
Fernández-Alacid, L., Sanahuja, I., Ordóñez-Grande, B., Sánchez-Nuño, S., Viscor, G., Gisbert, E., Herrera, M., Ibarz, A. (2018). Skin mucus metabolites in response to physiological challenges: A valuable non-invasive method to study teleost marine species. Science of the Total Environment, 644, 1323–1335. https://doi.org/10.1016/j.scitotenv.2018.07.083
Guardiola, F.A., Cuartero, M., Collado-González, M.M., Arizcún, M., Díaz Banos, F.G., Meseguer, J., Cuesta, A., Esteban, M.A. (2015). Description and comparative study of physico-chemical parameters of the teleost fish skin mucus. Biorheology, 52, 247–256. https://doi.org/10.3233/BIR-15052
Holst, M.-M., Hauver, C.M., Stein, R.S., Milano, B.L., Levine, L.H., Zink, A.G., Watters, J.V., Crook, R.J. (2022). Behavioral changes in senescent giant pacific octopus (Enteroctopus dofleini) are associated with peripheral neural degeneration and loss of epithelial tissue. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 271, 111263. https://doi.org/10.1016/j.cbpa.2022.111263
Jereb, P., & Roper, C.F.E. (2005). No. 2. Chambered nautiluses and sepioids (Nautilidae, Sepiidae, Sepiolidae, Sepiadariidae, Idiosepiidae and Spirulidae). In Cephalopods of the World: An Annotated and Illustrated Catalogue of Cephalopod Species Known to Date (Vol. 1, pp. 204–212). Food & Agriculture Organization of the United Nations: Rome, Italy.
Parra, D., Reyes-López, F.E., Tort, L. (2015). Mucosal immunity and B cells in teleosts: Effect of vaccination and stress. Frontiers in Immunology, 6, 354. https://doi.org/10.3389/fimmu.2015.00354
Pérez-Polo, S., Imran, M.A.S., Dios, S., Pérez, J., Barros, L., Carrera, M., Gestal, C. (2023). Identifying natural bioactive peptides from the common octopus (Octopus vulgaris Cuvier, 1797) skin mucus by products using proteogenomic analysis. International Journal of Molecular Sciences, 24, 7145. https://doi.org/10.3390/ijms24087145
Roura, A., Castro-Bugallo, A., Martínez-Pérez, M., Guerra, A. (2024). Senescence in common octopus, Octopus vulgaris: Morphological, behavioural and functional observations. Applied Animal Behaviour Science, 275, 106294. https://doi.org/10.1016/j.applanim.2024.106294
Savin-Amador, M., Hernández-Rubio, J.S., Caballero-Cosío, M.A., Rojas-Contreras, M., González-Pérez, N.F. (2024). Evaluation of the antibacterial activity of the skin mucus of the common octopus Octopus bimaculatus against pathogenic bacteria of farm animals. Revista Bio Ciencias, 11, e1521. https://doi.org/10.15741/revbio.11.e1521
Schachter, H., & Williams, D. (1982). Biosynthesis of mucus glycoproteins. In Mucus in Health and Disease II (pp. 3–28). Chantler, E., Elder, J., Elstein, M. (Eds.). Plenum Press: New York, NY, USA. https://doi.org/10.1007/978-1-4615-9254-9_1
Schmidtberg, H. (1999). Ultrastructural studies of the suckers of newly hatched Eledone moschata and Octopus vulgaris (Mollusca; Cephalopoda). In Advancing Research on Living and Fossil Cephalopods (pp. 203–221). Springer: Boston, MA, USA. https://doi.org/10.1007/978-1-4615-4837-9_15
Suárez, L., Pereira, A., Hidalgo, W., Uribe, N. (2021). Antibacterial, antibiofilm and anti-virulence activity of bioactive fractions from mucus secretion of giant African snail Achatina fulica against Staphylococcus aureus strains. Antibiotics, 10, 1548. https://doi.org/10.3390/antibiotics10121548
Sobre los autores:
Macario Savin-Amador: Es profesor investigador en la Universidad Tecnológica de
La Paz e investigador posdoctoral SECIHTI en el Departamento Académico de
Ciencias Marinas y Costeras de la Universidad Autónoma de Baja California Sur (UABCS) trabajando con la identificación de genes resistentes a antibióticos en bacterias de origen acuáticas.
Liliana Hernández-Olalde: Profesora Investigadora del Departamento Académico de
Ciencias Marinas y Costeras de la UABCS. Su línea de investigación incluye
bacterias y su metabolismo impartiendo el curso de biología celular.
Oscar Trujillo-Millán: Profesor Investigador del Departamento Académico de
Ciencias Marinas y Costeras de la UABCS, se especializa en estudios de biología,
fisiología y ecología de peces marinos.
.png)